Abstract (개요)
배경: 노화는 신체발달의 불가피한 단계이다. 동시에 노화는 암, 심혈관 질환 및 그리고 신경퇴행성 질환의 주요 원인이다. 한약재는 노화를 늦추는 천연 물질로서 미래 항노화 약재로 개발되리라 기대된다.
목적: 이 논문은 23가지 전통 한약재의 항노화 작용과 그 유효 성분에 관한 고찰이다.
재료 및 방법: 우리는 PubMed, EMBASE, Scopus 및 Web of Science 데이터베이스를 통해 얻은 한약재 또는 그 활성 성분의 항노화 역할에 대해 지난 5년 동안 출간된 문헌을 고찰했다.
결과: 총 2,485편의 논문이 검색되었고, 중복을 제거하고 제목을 읽은 후 212편의 논문을 선별하였다. 그중 23개의 연구가 이 검토의 요구 사항을 충족하고 포함되었다. 이 중 13편은 Caenorhabditis elegans를 동물 모델로, 10편은 다른 동물 모델이나 세포주를 사용하였다.
결론: 한약재 또는 그 활성 성분은 다양한 신호 경로를 통해 노화와 관련된 유전자를 조절함으로써 항노화 역할을 한다. 한약재는 항노화 약물로 개발되거나 의료미용산업에서 활용될 것으로 기대된다.
1. Introduction (서론)
노화는 연령이 증가함에 따라 발생하는 생체 전체 기능의 퇴행성 변화이다 [1]. 노화는 매우 복잡한 생물학적 과정이며 그 기전은 유전적 돌연변이, 텔로미어 손실, 체세포 돌연변이, 활성산소에 의한 손상, 면역 장애, 미토콘드리아 기능 장애 및 자가포식 기능 장애 이론을 포함한다 [2,3]. 심혈관 질환, 암, 백내장, 골다공증, 고혈압, 알츠하이머병, 파킨슨병과 같은 퇴행성 신경 질환은 모두 노화와 관련이 있다 [4-6]. 고령화 사회로 접어들면서 많은 국가들이 고령화 사회에 진입하고 있으며, 이는 경제 발전과 사람의 생명과 건강에 심각한 위협이 되고 있다. 따라서 노화 기전과 항노화 약물에 대한 연구가 시급하다 [7]. 신체의 수명 주기는 인슐린 및 인슐린 유사 (인슐린/IGF-1 신호전달 [IIS]), 식이 제한 (DR), 생식선 (생식선 신호 [GR]), 및 미토콘드리아 (미토콘드리아 신호전달 [mTOR]) 신호전달 경로와 같은 다양한 신호전달 경로와 전사를 포함한다 [8-10]. 이러한 신호전달 경로는 보존되는 것으로 나타났으며, 이는 건강을 개선하기 위한 수명연장 약물 및 전략에 대한 검색에 긍정적인 도움이 된다 [11,12].
연구에 따르면 약물 요법은 노화를 효과적으로 지연시킬 수 있으며 노화 관련 질병에 긍정적인 영향을 미치는 것으로 나타났다. 아스피린과 메트포르민 (metformin)은 일반적으로 합성 항노화 약물로 사용되지만 [13,14], 이들 약물 역시 상당한 부작용이 있다. 아스피린은 항혈소판 응집을 유발하고 장기간 사용하면 쉽게 출혈이 일어날 수 있으며, 메트포르민 (metformin)을 복용하는 환자는 설사, 메스꺼움, 복부 불편감 등의 이상반응이 나타날 수 있다 [15,16]. 항노화 약물은 발견과 개발이 어렵고 진행이 더디다. 따라서 안전하고 효과적인 항노화 약물을 찾는 것이 어렵다. 최근 한약재는 안전하고 효과적인 항노화 약물로서 개발 잠재력이 크다 [17].
한약재란 한의학 이론을 바탕으로 질병을 예방하고 치료하는 물질로서 재활과 건강관리의 기능을 하는 물질을 말한다 [18]. 한약재는 만성 질환에 유익하다 [19]. 예를 들어, 생강은 심혈관 질환의 위험 증가와 관련된 전신 염증 지표인 순환 C-반응성 단백질 (CRP) 및 종양괴사인자-α (TNF-α) 수치를 줄이는 데 상당한 효과가 있다 [20]. 커큐민은 다낭성 난소 증후군과 관련된 고안드로겐혈증 및 고혈당증을 개선할 수 있다 [21]. 또한 최근 연구에 따르면 다양한 한약재 및 그 활성 성분이 노화를 지연시키고 노화 관련 질병을 예방할 수 있음이 밝혀졌다 [22,23]. 한약재에서 다당류, 단당류 또는 세스퀴테르펜은 항염증, 항종양, 항바이러스, 아카로이드 (acaroid), 진정 효과가 있어 신약 개발의 잠재적 원천으로 간주된다 [24,25]. 이 논문에서는 한약재 또는 그 활성 성분의 항노화 및 항산화 효과를 체계적 고찰 방법으로 연구했다.
2. Materials and Methods (재료 및 방법)
고찰은 Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) 진술을 따랐다 [26].
2.1. Search Strategy (검색 전략)
영어 출판물은 PubMed, Scopus, Embase 및 Web of Science 데이터베이스에서 검색되었다. 모든 데이터베이스는 Medical Subject Title Index (MESH/DECS)로 2020년 11월 30일까지로 제한했다. 검색에 다음 키워드의 다양한 조합이 사용되었다: "중국 전통 의학", "TCM", "한약재", "노화", "노화 방지", "노년기" 및 "전통 의학". 또한 논문 검색 시 발견되지 않은 보고서를 찾기 위해 선택한 모든 논문의 참고문헌을 살펴보았다.
2.2. Study Selection (연구 선택)
저자들은 논문의 제목과 초록을 읽고 “노화를 지연시키는 한약재 또는 그 유효 성분”의 기준에 맞지 않는 논문을 제외했다. 한약재 또는 그 활성 성분의 노화 방지 효과는 시험관 내 및 생체 내에서 연구되었으며 가능한 메커니즘이 논의되었다. 다음 유형의 논문은 이 고려 대상에서 제외되었다. 초록, 사설/레터 검토 논문, 메타분석, 세미나 자료 모음, 사례 보고서, 특허, 임상 연구 및 최근 5년 이전에 출간된 논문. 세 번째 저자는 두 저자 간의 의견 차이를 결정할 권리가 있다.
2.3. Data Extraction (데이터 추출)
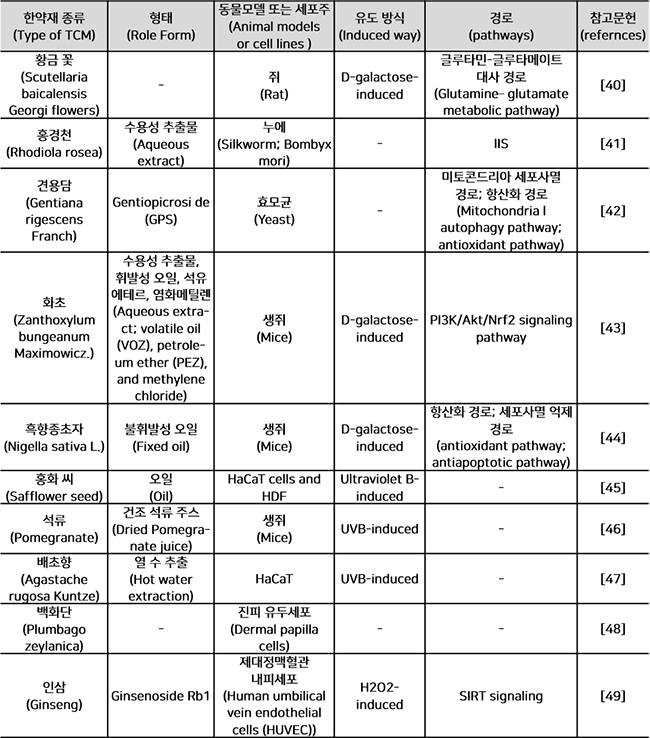
한 저자는 논문의 데이터를 요약하고, 다른 저자는 데이터를 조사했다. Caenorhabditis elegans는 노화 연구의 대표적인 모델이다. C. elegans를 모델로 한 실험에서 얻은 한 쌍의 데이터는 Table 1에 별도로 요약되어 있다. Table 2는 다른 동물 모델 또는 세포주의 실험 데이터를 요약한 것이다.
Table 1. Caenorhabditis elegans를 모델로 한 TCM 및 그 활성 성분의 노화 방지 연구
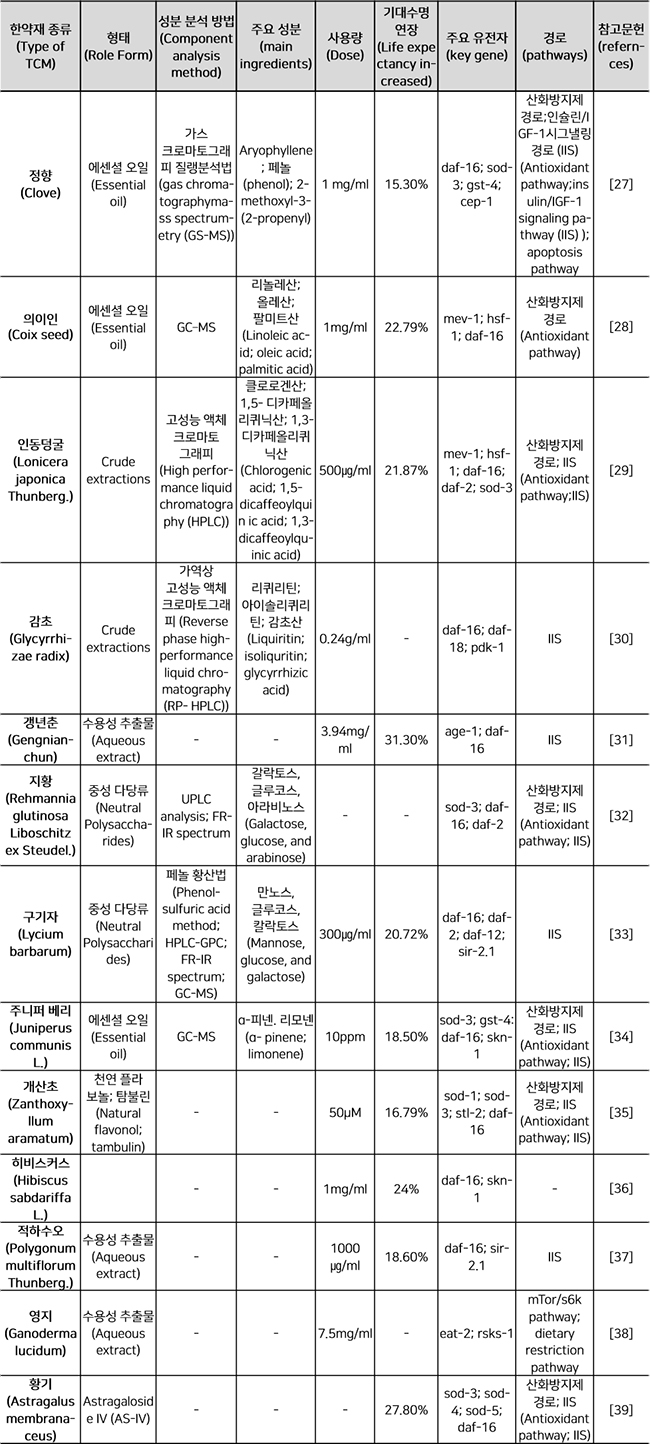
Table 2. 다른 동물 또는 세포 모델을 기반으로 한 한약재 또는 그 활성 성분의 노화 방지 연구
2.4. Methodological Quality Assessment (방법론적 품질 평가)
임상연구 편향의 위험과 품질을 위해 최적화된 체크리스트가 사용되었다 [50,51]. 여기에는 블라인드 (blind) 투여 및 결과, 평균 치료 분포 및 기타 요소가 포함된다.
2.5. 데이터 분석
연구의 이질성을 감안할 때 데이터는 보고식으로 제시되었으며 통합 통계, 민감도 분석, 메타분석은 사용되지 않았다.
3. Results and Discussion (결과 및 논의)
3.1. Search Results (검색 결과)
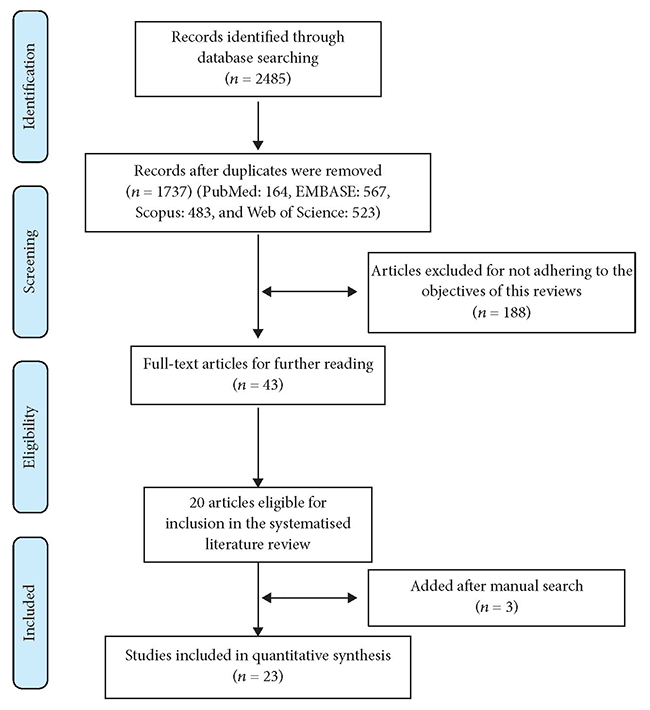
Figure 1은 검색 흐름도를 보여준다 [52]. 중복되지 않는 총 1,737개의 논문을 대상으로 하였다 (PubMed: 164, EMBASE: 567, Scopus: 483, Web of Science: 523). 제목을 통해서, 한약재 및 항노화와 관련된 212개의 논문을 선정했다. 마지막으로 원문을 검색하여 본 논문에 23개의 논문을 수록하였다. 13개의 논문은 C. elegans를 동물 모델로 하고 나머지 10개의 논문은 다른 동물이나 세포를 기반으로 한다.
Figures 1. 이 고찰의 논문 검색 및 선택의 자세한 설명 순서도
3.2. Study Characteristics and Description (연구 특성 및 설명)
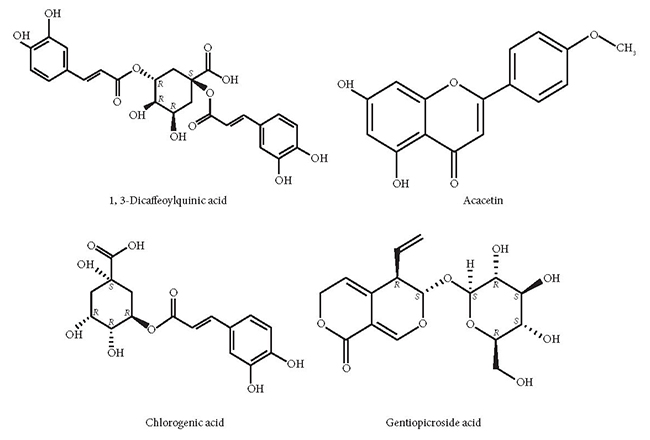
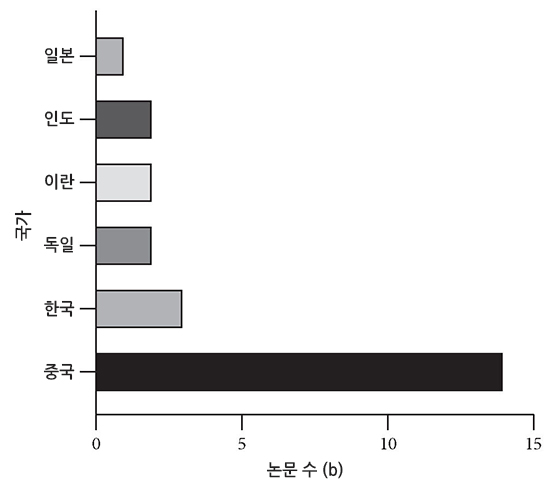
이 논문은 20개의 연구에 대한 체계적 문헌고찰을 제시한다. 13개의 논문에서 한약재 또는 한약재의 주요 구성 성분이 노화 지연에 미치는 영향을 조사하기 위해 전형적인 C. elegans를 동물 모델로 사용했다. 다른 7개 논문은 누에, 효모, 자외선 (UV) 유도 노화 세포, 자외선 유도 피부 노화 마우스 및 기타 노화 모델에 대한 한약재 또는 그 활성 성분의 효과를 연구했다. 다양한 한약재 또는 그 활성 성분은 노화에 억제 효과가 있다. 한의학의 주요 구성 성분 중 일부의 화학 구조는 Figure 2에 나와 있다. 또한, 14개 논문은 중국; 2개는 인도; 2개는 독일; 2개는 이란; 3개는 한국; 하나는 일본 논문이다.
Figure 2.한약재의 일부 주요 구성 성분의 화학 구조
C. elegans를 모델로 한 한약재 또는 활성 성분의 노화 방지 실험에서 여러 방법이 보고되었다. 장수 실험은 선충류의 수명 연장에 대한 한약재의 효과를 조사하는 데 사용된다. 한약재가 선충류의 건강 상태에 미치는 영향은 선충류의 몸길이를 측정하고 몸의 스윙 속도와 운동 능력을 관찰하는 것으로 평가된다. 스트레스에 대한 C. elegans 저항성에 대한 한약재의 효과는 열, 산화 및 중금속 스트레스 테스트를 사용하여 평가된다. C. elegans의 번식력은 선충류의 번식력과 선충류 생식의 우성 비를 세어 평가한다. 한약재의 항산화 능력은 선충류의 활성산소종 (ROS)과 항산화 효소 수준을 검출하여 평가되었다. 다양한 단백질과 mRNA의 발현 수준은 transcriptome sequencing, Western blot, Q-PCR에 의해 검출된다. 또한 일부 논문에서는 노화 관련 질병에 대한 한약재의 효과를 연구했다.
한약재의 항노화 효과를 연구하기 위한 C. elegans의 전형적인 모델 외에도 효모, 누에 및 기타 자연 노화 모델이 많은 실험에 사용된다. 다른 노화 모델에는 모발 진피 유두 (DP) 세포, UV 유도 헤어 리스 마우스 (hairless mouse) 피부 노화 모델, UV 유도 HaCaT 세포 및 인체 진피 섬유아세포, H2O2 유도 HUVECs 노화 및 D-갈락토스 (D-galactose-induced) 유도 노화 마우스가 포함되어 있다. 방법에는 세포 생존율 분석, 웨스턴 블롯 (Western blot) 분석, β-갈락토시다아제 (β-galactosidase) 활성에 대한 염색, 총 콜라겐 측정, 스트레스 내성 및 항산화 활성, 항산화 효소 함량 측정 및 기타 방법이 포함된다. 앞서 언급한 실험 방법을 통해 한약 또는 그 활성 성분의 명백한 항노화 효과가 입증되었다.
3.2.1. Effect of TCM or Its Active Component on Prolonging the Life of C. elegans (C. elegans의 수명 연장에 대한 한약재 또는 그 활성 성분의 효과)
C. elegans는 미생물을 먹고 사는 다세포 유핵 생물이다. 선충류는 짧은 수명 주기, 강한 번식력, 포유류와의 높은 상동성 유전자 [53,54], 실험에서 유지관리가 쉬운 등의 독특한 장점이 있다. 이러한 이점으로 인해 다른 동물과 다르다. 그 결과 C. elegans는 노화 연구의 전형적인 모델이 되었다.
정향 에센셜 오일 (CEO, Clove Essential Oil)의 주요 화합물은 카리오필렌 (caryophyllene), 페놀 (phenol) 및 2-메톡시-3- (2-프로페닐) (2-methoxyl-3-(2-propenyl))이다 [27]. 미국 식품의약국 (FDA)에 따르면 CEO는 일반적으로 식품 첨가물로 사용하기에 안전한 것으로 인정된다 (미국 연방 코드, 21CFR184.1257). CEO는 선충류의 수명을 크게 연장하고 생식 능력과 건강을 향상시킨다. CEO는 sod-3 및 gst-4의 발현을 유도하여 항산화 활성을 발휘한다. 또한 CEO는 daf-16/Forkhead box O (FOXO) 핵 이식을 유도하고 cep-1 및 daf-16-dependent 세균 세포사멸을 유도한다.
의학적 가치가 뛰어난 한약재 의이인 (Coix seed)은 중국과 일본에 널리 자생한다. 의이인 오일 (CSO, Coix seed oil)은 혈액 지질 저하, 항산화 [55,56] 및 항암 효과가 있으며 선충류의 노화를 지연시킬 수 있다 [28]. 노화는 환경 스트레스와 밀접한 관련이 있지만 [57], CSO는 열 스트레스, 산화 스트레스 및 중금속 스트레스에 대한 선충류 저항성을 향상시킬 수 있다. CSO는 daf-16과 그 다운스트림 (downstream) 유전자를 유도하여 선충류의 노화를 지연시키고 스트레스 저항성을 향상시킨다. CSO의 리놀레산 (Linoleic), 올레산 (oleic), 팔미트산 (palmitic) 및 스테아르 산 (stearic acids)은 이 과정에서 핵심적인 역할을 한다.
인동덩굴 (LJ, Lonicera japonica Thunberg.)은 일본 인동덩굴 [58]로도 알려져 있으며 주요 성분은 클로로겐 산이다 [29]. 연구에 따르면 L. japonica의 75% 에탄올 추출물 (LJ-E)은 인슐린/IGF-1 신호전달, 항산화 및 자가포식 경로를 통해 선충류의 수명을 연장할 수 있다. 동시에, LJ-E는 몸의 스윙과 인두의 펌핑 빈도의 증가, 열 및 산화 스트레스에 대한 저항력 향상, 생체 내 ROS 수준 감소를 포함하여 C. elegans의 건강 상태를 개선한다. 또한 LJ-E와 그 추출물은 선충류의 노화를 지연시키고 알츠하이머병을 예방할 수 있다.
감초 (GR, Glycyrrhizae radix)는 소화성 궤양, C형 간염 및 피부 질환을 치료하기 위해 일반적으로 다른 한약재와 함께 사용된다 [59-62]. 최근 연구에 따르면 GR에 장기간 노출되면 선충류의 수명이 연장되고 운동 능력이 향상되며 장내 ROS 생성이 감소할 수 있다 [30]. 또한 GR 처리는 장수 조절에 중요한 역할을 하는 인슐린 유사 신호전달 경로를 코딩하는 유전자의 발현 패턴을 변경한다 [11].
갱년춘 (GNC, Geng Nian Chun)은 노화와 관련된 기능 손실을 개선하는 데 사용되는 12가지 한약 (즉, 숙지황, 황련, 작약 뿌리, 지모, 육종용, 파극천 (Radix Rehmanniae, Rhizoma Coptidis, Radix Paeoniae Alba, Rhizoma Anemarrhenae, Cistanche salsa 및 Radix Morindae officinalis) [63])으로 구성되어 있다. GNC로 처리된 야생형 선충류는 정상 및 산화 스트레스 조건에서 생존 시간의 연장을 나타내지만 daf-16 돌연변이가 있는 선충류는 항산화 스트레스 효과가 없다. 이 결과는 GNC의 수명 연장 및 항산화 스트레스 효과가 daf-16/FOXO-dependent을 통해 실현되었음을 시사한다. 추가적인 연구는 GNC가 daf-2, age-1 및 daf-16 돌연변이 균주의 수명을 연장할 수 없음을 보여준다. 이 결과는 GNC가 IIS 경로를 통해 선충류의 수명을 연장할 수 있으며 항노화 약물 개발에 잠재적으로 사용될 수 있음을 의미한다 [31].
의학적 가치가 뛰어난 한약재 지황 (PRG, Rehmannia glutinosa Liboschitz ex Steudel.)은 항염, 항균, 항암 작용을 하며 심혈관 기능을 보호할 수 있다. 최근 연구에 따르면 성숙한 PRG의 주성분은 중성 다당류이다. 이 중 기능성 약제 성분인 NPRG의 중성 다당류는 IIS 경로를 통해 daf-2 및 daf-16 유전자를 조절함으로써 항스트레스 능력을 향상시키고 선충류의 수명을 연장시킬 수 있다 [32].
Lycium barbarum polysaccharide (LBP)는 구기자 (L. barbarum)의 주요 활성 성분 중 하나이다. LBP는 선충류의 수명을 연장하고 가혹한 환경에 대한 저항성을 향상시키며 생식 능력을 개선하고 선충류의 근육 보존을 확보할 수 있다. RNAi 유전자는 돌연변이 선충류 균주로 발현이 차단되고 mRNA 발현 수준이 측정된다. 돌연변이 된 선충류 균주를 사용하여 RNAi는 N2 및 sir-2.1 돌연변이의 daf-16 유전자 발현을 차단시키고 그들의 mRNA 발현 수준을 측정하여, LBP의 수명연장 활성은 sir-2.1, daf-12 및 daf-16 유전자를 조절함으로써 이루어진다는 것이 입증되었다 [33].
강력한 해독제 및 면역 체계 부스터로서 노간주나무 열매 주니퍼 베리 (Juniper Berry)는 종종 기회 감염을 치료하는 데 사용된다 [64]. 주니퍼에서 추출한 주니퍼 에센셜 오일 (JBEO)은 시험관 내 실험에서 특정 항산화 및 항-유리기 활성을 가지고 있다 [65]. 또한, JBEO는 생체 내에서 선충류의 수명을 연장하고 산화 스트레스 및 열 스트레스에 대한 선충류의 저항성을 향상시킬 수 있다. 한편, sod-3 (39.49%) 및 gst-4 (25.13%)의발현 증가가 관찰되었다. JBEO 수명연장 활성의 메커니즘을 탐색할 때 보존된 전사 인자 (daf-16, skn-1 및 hsf-1)가 이 과정에 관여하는 것으로 밝혀졌다 [34].
탐불린 (Tambulin)은 개산초 (Zanthoxylum armatum)에서 분리된 하이드록시 요오드 플라바놀 (hydroxyl iodic flavonol)이다. 노화는 헌팅턴 증후군 (Huntington’s syndrome), 파킨슨병 (Parkinson’s disease), 알츠하이머병 (Alzheimer’s disease) 등 퇴행성 신경 질환의 주요 원인이다 [6,66]. 선충류의 수명과 스트레스 내성은 Tambulin 처리에 의해 크게 향상되며, 이러한 현상은 리포푸신 (lipofuscin) 및 단백질 카르보닐 (carbonyl)과 같은 노화 바이오마커 (biomarkers)의 완화를 보인다. 감소된 ROS 수준과 일치하게, Tambulin 처리는 ROS-removing 유전자, 즉 sod-1, sod-3 및 ctl-2의 상향조절 (upregulated) mRNA 발현을 초래한다. Tambulin 요법은 파킨슨병 치료에 효과적인 것으로 나타났다; alpha-synuclein의 레벨 및 지질 축적 감소; 운동 행동 개선; 도파민 수치 상승 [35].
이전 연구에 따르면 히비스커스 꽃 (Hibiscus sabdariffa L.)은 여성 환자의 피부 노화 지표를 상당히 감소시킬 수 있으며 [67], 나이 든 흰쥐의 장단기 기억력 결핍을 개선할 수 있다 [49]. 선충류를 동물 모델로 사용한 최근 연구에 따르면 히비스커스 꽃 (H. sabdariffa L.) 추출물 (HSE)은 생체 내에서 선충류의 수명을 현저하게 연장하고 연령에 따른 운동 능력 감소를 늦출 수 있다 [36]. HSE의 이러한 역할은 주요 전사 인자 daf-16 및 skn-1에 따라 다르다. 동시에 HSE는 세포 내 ROS 수준을 증가시켜 HSE가 산화 촉진제 활성을 가지고 있음을 나타낸다. HSE는 아밀로이드-베타 (amyloid-beta) 단백질 유도 독성에 내성이 있으며 수명 연장 효과가 있다.
적하수오 추출물 (PME, Polygonum multiflorum extract)는 쥐의 간과 뇌에서 리포푸신 (lipofuscin)의 축적을 감소시킬 수 있으며 [49] nigra striatum 조직의 퇴행에 신경 보호 효과가 있다. 동시에 PME는 항산화 효과가 있으며 PME에 노출된 선충류는 항산화 스트레스 능력이 향상되었다. 또한 PME는 daf-16 및 sir-2.1을 조절하여 C. elegans의 평균 수명을 연장하고 ROS 축적을 감소시킬 수 있다 [37].
현재 영지 (Ganoderma lucidum)의 임상 적용은 면역 반응 조절 및 염증 반응 감소와 같은 보조 요법에 국한되어 있지만 [68,69], 그 약리학적 기전은 불분명하다. 최근 연구에 따르면 영지 (G. lucidum)는 제초제 파라콰트 (paraquat) 유도 산화 스트레스 및 중금속 스트레스에 대한 선충류의 저항성을 효과적으로 개선하고 수명을 연장할 수 있음을 보여주었다. 선충류에 대한 영지 (G. lucidum)의 보호 효과는 식이 제한 및 mTOR/S6K 신호전달을 통해 발휘될 수 있다. 반면 선충류의 수명연장은 생식세포 신호전달 경로에 좌우된다 [38].
Astragalus armor glycoside IV (AS-IV)는 건조한 황기 뿌리에서 분리되어 염증, 바이러스 및 암 치료에 널리 사용된다 [70]. AS-IV 처리된 선충류의 수명은 산화 스트레스, 열 스트레스 및 정상적인 조건에서 연장되었다. 동시에 AS-IV는 슈퍼옥시드 디스무타제 (SOD, Superoxide dismutase) 및 과산화효소의 활성을 향상시키고 글루탐산 (glutamic) 함량을 증가시키며 선충류의 포도당 (glucose) 함량을 감소시킬 수 있다. 흥미롭게도 sod-1, sod-2, sod-3, sod-4, sod-5, ctl-1, ctl-2, ctl-3 및 daf-16 돌연변이의 수명은 AS-IV 처리로 변하지 않았다. 이러한 결과는 AS-IV의 수명연장 활성이 노화 관련 기능 저하 및 항산화 능력을 개선하고 IIS 경로의 활성을 부분적으로 조절함으로써 이루어지는 것을 나타낸다 [39].
3.2.2. Effect of TCM or Its Active Components on Delaying Senescence in Other Animal Models or Cell (다른 동물 모델 또는 세포의 노화 지연에 대한 한약재 또는 그 활성 성분의 효과)
C. elegans 모델 외에도 누에, 효모 및 수명 주기가 짧은 기타 자연 노화 모델은 한약재 또는 그 활성 성분의 항노화 연구에 사용되었다. 자연 노화 모델 외에도 UV 유도 노화 세포와 털이 없는 마우스는 일반적으로 피부 노화 시뮬레이션에 사용되었다. DP 세포 노화 모델을 사용하여 탈모를 시뮬레이션 했다; H2O2-induced HUVECs 노화는 심혈관 질환 연구에 사용되었다. 또한 D-galactose-induced 노화 마우스는 항노화 약물 연구의 주요 수단 중 하나이다. 한약재 또는 그 유효 성분은 체내에서 노화 방지 효과가 있고 피부 노화를 현저하게 억제하는 효과가 있다.
황금 (Snutellaria baicalensis Georgi) 꽃 추출물 (SFE)은 주로 공간 기억 능력을 향상시킬 수 있는 플라보노이드로 구성되어 있다. 연구에 따르면 SFE는 malondialdehyde (MDA), SOD 및 최종 당화 생성물을 조절하고 간 병리학적 기형을 크게 개선할 수 있었다. 또한 SFE는 D-글루타민 (D-glutamine) 및 D-글루타메이트 (D-glutamate)의 수준을 상당히 증가시킨다. SFE는 글루타민-글루타메이트 (glutaminw-glutamate) 대사 경로를 조절하여 항노화 역할을 하는 것으로 추측된다 [40].
홍경천 (Rhodiola Rosea)의 수용성 추출물은 음식 섭취, 체중 또는 생식력을 변화시키지 않고도 누에의 수명을 크게 연장하고 열 스트레스와 배고픔에 대한 저항력을 향상시킬 수 있다. 동시에 홍경천 (R. rosea) 처리는 glutathione S-transferase와 catalase의 활성을 증가시키고 glutathione과 MDA의 함량을 변화시킨다. 또한, BmFOXO의 mRNA 발현은 홍경천 (R. rosea) 처리 후 두드러지게 증가하였다 [41]. BmFOXO는 IIS 경로의 핵심 전사 인자이며 IIS 경로의 다운스트림 (downstream)으로 작용한다 [71]. 따라서 IIS는 홍경천 (R. rosea)에 의해 유도된 누에 수명 연장에 관여할 수 있다.
용담 (Gentiana rigescens)에서 분리된 Gentiopicroside (GPS)는 항노화 효과가 있는 iridoid glycoside 배당체 화합물이다. GPS는 효모의 복제 및 시간상 수명을 효과적으로 연장하고 산화 스트레스 하에서 효모의 생존율을 향상시키며 카탈라아제 (catalase), SOD 및 글루타티온 퍼옥시다제 (glutathione peroxidase)의 활성을 향상시킨다. 또한, 세포질의 유리 GFP, 미토콘드리아의 유리 GFP 및 ubiquitin의 수준은 GPS 처리 후 두드러지게 증가했다. 자가포식, 특히 미토콘드리아 자가포식 및 항산화 스트레스는 GPS 유도 수명 연장에 관여했다 [42].
화초 (Zanthoxylum bungeanum Maximowicz.)의 수용성 추출물 (WEZ)과 휘발성 오일 (VOZ)은 기억 장애를 완화하고 D-갈락토오스 (D-galactose-induced)로 인한 해마 신경 손상을 예방할 수 있다. 또한 WEZ와 VOZ는 phosphatidylinositol 3-kinase (PI3K)/proteinase B (Akt)의 활성을 향상시킨다. 기억 장애에 대한 화초의 분명한 치료 효과는 PI3K/Akt 신호전달 경로의 활성화와 관련이 있을 수 있다 [43].
수컷 쥐에게 42일 동안 D-갈락토스 (D-galactose)를 피하 주사한 후 노화를 유도하였다. 흑향종초자 (Nigella sativa L.) 오일로 치료 후 쥐의 지질 과산화가 감소하였다. 흑향종초자 오일 (0.1 및 0.2 mL/kg)은 GSH 함량을 크게 회복시키고 Bax/Bcl2 수준을 감소시킨다. 또한, 0.1 mL/kg 흑향종초자 오일은 노화된 쥐의 뇌와 간에서 caspase-3 단백질의 발현을 하향조절한다. 흑향종초자 오일은 항산화 활성과 항세포사멸 효과를 통해 D-galactose 유도 노화 모델에서 항노화 역할을 할 수 있다 [44].
HaCaT 세포와 사람 진피 섬유아세포 (HDF)는 자외선에 의해 유도되어 세포가 노화된다. 홍화 씨 오일 (Charthamus tintorius L., SSO)과 주요 성분인 acacetin (5,7-dihydroxy-4'-methoxyflavone)은 노화된 HaCaT 및 HDF 세포에서 기질 금속단백분해효소 (metalloproteinases) (MMP-1)의 발현을 억제한다 [72]. MMP-1은 콜라겐 분해와 주름 형성에 중요한 역할을 한다. SSO와 acacetin은 MMP-1을 통해 피부 노화를 억제할 수 있다 [45].
UV 방사선은 피부 구조를 손상시키고 피부 노화를 일으키는 ROS를 생성할 수 있다. 피부 노화는 털이 없는 생쥐의 UV 조사를 통해 시뮬레이션 되었다 [73]. 석류 과즙 농축 분말 (PCP)의 치료는 광노화로 인한 피부 주름과 부종을 크게 개선하고 피부 수분, type I 콜라겐 및 히알루론산 (hyaluronic acid) 함량을 크게 증가시킬 수 있다. 또한 글루타티온 (glutathione) 소모는 PCP 요법에 의해 억제된다. 또한, PCP는 UV에 노출된 쥐의 피부에서 MMP-1, 9, 13 및 NOX2 mRNA의 발현 수준을 감소시킨다. PCP는 UVB에 의해 유발되는 피부 노화에 대한 좋은 보호 효과를 가진다 [46].
다년생 허브인 배초향 (Agastache rugosa Kuntz)은 박하과 (꿀풀과)에 속한다. 배초향 (A. rugose)은 acacetin-7-O-β-D-glucopyranoside (tilianin), acacetin, linarin, agastachoside 및 rosmarinic acid를 포함한 여러 종류의 플라보노이드를 함유한다 [74]. 배초향 (Agastache rugosa Kuntze) 잎의 열수 추출물 (ARE)은 UV-B에 의해 유도된 ROS 생성을 약화시키고 ProMMP-2 및 -9의 활성 및 단백질 수준을 감소시키며, HaCaT 각질형성 세포 (keratinocytes)에서 UV-B에 의해 감소된 총 GSH와 총 SOD의 활성 수준을 증가시킬 수 있다 [47]. UV-B 유도 광노화 HaCaT 각질형성 세포 (keratinocytes)에 대한 ARE의 보호 효과는 총 GSH 및 SOD를 포함한 항산화 성분의 상향조절 (upregulation)에 기초할 수 있다.
DP 세포는 안드로겐성 탈모증 (AGA)의 발생과 발달에 중요한 역할을 한다 [75]. 노화된 DP 세포는 SRD5A2의 발현을 상향조절 (upregulating)함으로써 AGA의 발생에 관여할 수 있다. 백화단 (Plumbago zeylanica 또는 Chitrak) 및 그 구성 성분은 DP 세포의 성장을 촉진하고 DP 세포에서 SRD5A2의 발현을 하향조절 (downregulate) 할 수 있다 [48]. 백화단 (Plumbago zeylanica)이 AGA 치료에 사용될 수 있다고 추측된다.
내피세포 노화는 심혈관 질환 (CVD)을 유발하는 주요 위험 인자이다 [76,77]. 과산화수소 (H2O2)에 의해 유발된 혈관 내피 기능 장애는 부분적으로 노화 진행의 원인이 된다 [78,79]. 진세노사이드 RB1 (Ginsenoside RB1 (RB1))은 진세노사이드 (ginsenoside)의 주요 성분으로 산화스트레스, 항비만, 항염 등의 생물학적 활성을 가지고 있다 [80-82]. 연구에 따르면 RB1은 과산화수소 (H2O2)에 의한 SIRT1 발현 감소를 회복시키고 AMPK 인산화를 활성화하여 과산화수소 (H2O2)에 의한 노화로부터 HuVec을 보호하는 것으로 나타났다 [81]. 이것은 노화와 관련된 심혈관 질환을 예방하는 새로운 방법을 제공한다.
3.3. Methodological Quality/Risk of Bias (방법론적 품질/편향 위험)
Figure 3은 이 고찰의 방법론적 특징을 소개한다. 모든 논문에는 한약재 치료 빈도와 실험동물의 나이 및 계통이 자세히 설명되어 있다. C. elegans와 누에를 동물 모델로 한 실험은 동물 보호 평가 위원회의 승인이 필요하지 않으며, 지원이 필요한 실험은 이미 승인을 받았다. 연구의 주요 목적과 결과는 모든 논문에 정확하게 표현되었다.
Figure 3. 생체 내 연구의 방법론적 품질

Figure 4와 5는 리뷰에서 각 논문의 출간 연도와 국가를 나타낸다. 표현 연도의 관점에서 볼 때 출간되는 논문의 수는 매년 증가하고 있다. 전통적인 치료법으로 한약재가 새로운 활력을 얻고 있으며, 그 항노화 효과도 주목받고 있다. 출간 국가 측면에서 한약재는 중국, 일본, 한국, 독일, 인도, 이란에서 널리 연구되고 있다. 한약재는 전 세계적으로 높이 평가되어 왔으며, 이에 대한 심도 있는 연구는 식물의 천연물을 기반으로 한 신약 개발을 촉진시켰다.
Figure 4. 리뷰 아티클이 게시된 연도
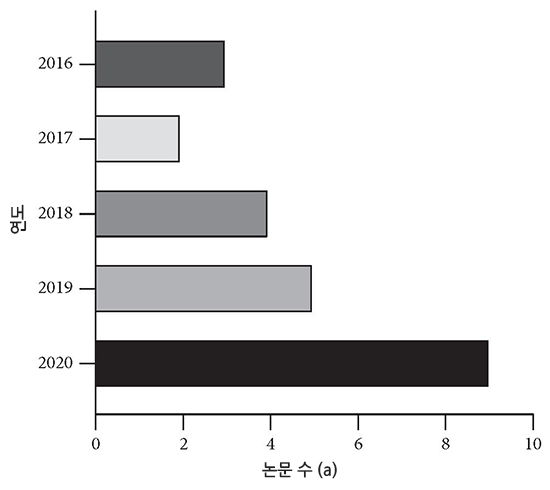
Figure 5. 리뷰 아티클 발행 국가
4. Conclusion (결론)
이 논문은 천연 제품인 한약재 또는 그 활성 성분의 노화 방지 및 항산화 잠재력을 검토한다. 한약재 또는 그 활성 성분은 다양한 노화 모델에서 상당한 노화 방지 효과를 나타낸다. 이번 고찰의 엄밀함을 감안할 때 아직 개선이 필요한 부분도 있지만 고찰에 포함된 논문의 질은 중간 또는 높은 수준이다.
IIS 경로는 노화를 조절하는 최초의 확인된 경로이다 [83]. 사람에서 선충류에 이르기까지 이 장수 조절 경로는 항상 높게 보존되어 왔다 [84, 85]. IIS 경로는 PI3K를 통해 작동하고 인슐린 펩타이드에 의해 활성화된다. Age-1 및 daf-2는 phosphoinositol-3 kinase (PI3K) 및 insulin/IGF-1 수용기를 암호화하고, 각각은 IIS의 주요 업스트림 (upstream) 구성 요소이다. 감소된 daf-2 기능은 AGE-1/PI3K로 시작하는 다운스트림 (downstram) kinase cascades 비활성화를 야기한다 [88]. age-1의 하향조절 (downregulation)은 3-phosphoinositol-dependent kinase 1 (PDK-1)을 비활성 한다 [89]. 이는 차례로 Akt/protein kinase B (PKB) 계열 구성원인 AKT-1 및 AKT-2를 하향조절 (downregulates) 한다 [89]. PI (3, 4, 5) P 3/PI (4, 5) P 2 비율은 DAF-18/phosphatase 및 tensin(PTEN) phosphatse의 활성화에 의해 감소될 수도 있다. 이것은 PI (3, 4, 5) P3의 탈인산화를 조정하고 수명을 증가시킨다 [88,90-92]. FOXO/DAF-16은 PI3K/Akt 경로에서 중요한 역할을 한다. 약한 인슐린 신호 조건에서 인산화되지 않은 FOXO/DAF-16은 핵으로 이동하여 유기체의 수명과 관련된 유전자의 전사를 촉진한다 [93,94]. 20건의 연구에 대한 체계적인 고찰을 통해 우리는 한약재의 노화 방지 효과의 대부분이 IIS 경로와 관련되어 있음을 발견했다. 의이인 (Coix seed) 에센셜 오일, 정향 (Clove) 에센셜 오일, 인동덩굴 (Lonicera japonica Thunberg.) 추출물, 감초 (Glycyrrhizae Radix) 추출물, 갱년춘 (Gengnianchun) 수용성 추출물, 지황 (Rehmannia glutinosa Liboschitz ex Steudel.) 중성 다당류, 구기자 (Lycium barbarum) 중성 다당류, 주니퍼 베리 (Juniperus communis L.) 에센셜 오일, 개산초 (Zanthoxyllum aramatum) 천연 플라보놀, 히비스커스 꽃 (Hibiscus sabdariffa L.), 적하수오 (Polygonum multiflorum Thunberg.) 수용성 추출물 및 황기 (Astragalus membranaceus astragaloside IV, AS-IV)는 모두 daf-16의 발현을 증가시킬 수 있다 [22–32,34]. C. elegans의 Hsf-1 발현은 의이인 에센셜 오일과 인동덩굴 추출물로 처리한 후 증가하였다 [23,24]. 지황 중성 다당류, 구기자 중성 다당류 및 인동덩굴 추출물로 처리한 후 C. elegans에서 daf-2의 발현 패턴은 낮았다 [24,27,28].
Sirtuin 계열은 nicotinamide dinucleotide (NAD+) 의존성 디아실라제 (deacylase)의 일종으로 질병 예방 및 노년기 지연에 중요한 역할을 한다 [95,96]. Silencing information regulator 1 (SIRT1) 및 SIRT6을 포함한 Sirtuins의 수준은 생쥐 배아 섬유아세포, 폐 상피세포, 사람 내피세포 및 대식세포에서 산화제에 노출된 노화 세포를 감소시킨다고 보고되었다 [97,98]. Sirtuin은 유전자 무결성을 유지 [96], 텔로미어 역전사 효소 발현 조절 [99], DNA 복구 촉진 [100-102], 노화 관련 유전자의 발현 변화, 줄기세포 자가 재생 유지 [103,104]에 능동적인 역할을 한다. Sirtuin은 또한 신체 수명을 조절한다. 신진 효모 Saccharomyces cerevisiae, 선충류, Drosophila melanogaster 및 생쥐의 수명은 sirtuin 수준의 증가에 따라 연장될 것이다 [105-108]. Sirtuin은 AMP 활성 단백질 kinase (AMPK), 인슐린/IGF-1 신호전달 경로 (IIS), rapamycin 표적 (TOR) 및 forkhead box O (FOXO) 와 같은 모든 주요 장수 보존 경로와 상호작용하는 것으로 밝혀졌다 [109-111]. LBP 처리 후 sir-2.1 유전자의 발현량이 증가하였고, sir-2.1 돌연변이에 대한 LBP의 장수 연장 효과는 N2보다 짧은 것으로 나타났다. 이는 LBP의 수명 연장 효과에 sir-2.1이 필요함을 의미한다 [33]. 또한 적하수오 (Polygonum multiflorum)는 야생형 Caenorhabditis elegans의 수명을 연장하고 제초제 파라콰트 (paraquat) 스트레스에 저항하는 능력을 향상시킬 수 있지만 sir-2.1 결핍 변종은 그렇지 않다. 커큐민 전처리는 HUVEC의 H2O2 유도 조기 노화를 두드러지게 감소시켰는데, 이는 노화 관련 β-갈락토시다아제 (β-galactosidase) 양성 세포 백분율의 감소, 세포 분열 능력의 강화 및 노화 관련 단백질 p21의 발현 감소로 보인다 [112]. SIRT1의 짧은 간섭 RNA (siRNA) 억제는 eNOS의 발현과 인산화를 감소시킬 수 있으며 H2O2로 인한 조기 노화에 대한 커큐민 보호 효과를 제거할 수 있다. 이러한 결과는 커큐민이 SIRT1을 활성화하여 산화 스트레스에 의해 유도된 HUVEC의 조기 노화를 감소시킬 수 있음을 시사한다. 진세노이드 (Ginsenoside)는 과산화수소 (H2O2)로 유도된 HUVEC에서 β-갈락토시다아제 (β-galactosidase)의 양성률을 감소시킬 수 있다는 것이 밝혀졌다. 또한, RB1은 eNOS 아세틸화를 감소시키고 SIRT1 발현의 증가와 함께 더 많은 NO 생성을 촉진했다. 흥미롭게도 SIRT1이 제거된 후 HUVEC 노화에 대한 RB1의 영향이 약화되었다 [113].
한약재의 항노화 효과에 대한 지속적인 연구와 항노화 경로 탐색은 새로운 항노화 약물의 연구 개발에 도움이 될 것이다.
Conflicts of Interest (이해 갈등)
저자는 이해 갈등이 없음을 선언한다.
Acknowledgments (감사의 말)
이 연구는 길림성 정밀감염병중점연구소 (보조금 번호 20200601011JC)의 지원을 받았으며, 길림성 중약2차개발기술혁신 식물항균펩티드계열 건강제품개발 (보조금 번호 20200404046YY), 길림성 발전개혁위원회센터 및 혁신능력건설프로젝트 (보조금 번호. 2019C030)의 자금 지원을 받았다.
References
[1] De Winter G. Aging as disease. Med Health Care Philos. 2015 May;18(2):237-43. doi: 10.1007/s11019-014-9600-y.
[2] da Costa JP, Vitorino R, Silva GM, Vogel C, Duarte AC, Rocha-Santos T. A synopsis on aging-Theories, mechanisms and future prospects. Ageing Res Rev. 2016 Aug;29:90-112. doi: 10.1016/j.arr.2016.06.005.
[3] Wysokiński A, Sobów T, Kłoszewska I, Kostka T. Mechanisms of the anorexia of aging-a review. Age (Dordr). 2015 Aug;37(4):9821. doi: 10.1007/s11357-015-9821-x.
[4] Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimers Dement. 2016 Apr;12(4):459-509. doi: 10.1016/j.jalz.2016.03.001.
[5] Faiz KW, Pihlstrøm L. Parkinsons sykdom og parkinsonisme. [Parkinson's disease and parkinsonism]. Tidsskr Nor Laegeforen. 2017 Feb 21;137(4):298. doi: 10.4045/tidsskr.16.0915.
[6] Wyss-Coray T. Ageing, neurodegeneration and brain rejuvenation. Nature. 2016 Nov 10;539(7628):180-186. doi: 10.1038/nature20411.
[7] Partridge L, Deelen J, Slagboom PE. Facing up to the global challenges of ageing. Nature. 2018 Sep;561(7721):45-56. doi: 10.1038/s41586-018-0457-8.
[8] Chen W, Shen X, Hu Y, Xu K, Ran Q, Yu Y, Dai L, Yuan Z, Huang L, Shen T, Cai K. Surface functionalization of titanium implants with chitosan-catechol conjugate for suppression of ROS-induced cells damage and improvement of osteogenesis. Biomaterials. 2017 Jan;114:82-96. doi: 10.1016/j.biomaterials.2016.10.055.
[9] Suzuki M, Bandoski C, Bartlett JD. Fluoride induces oxidative damage and SIRT1/autophagy through ROS-mediated JNK signaling. Free Radic Biol Med. 2015 Dec;89:369-78. doi: 10.1016/j.freeradbiomed.2015.08.015.
[10] Zhang H, Davies KJA, Forman HJ. Oxidative stress response and Nrf2 signaling in aging. Free Radic Biol Med. 2015 Nov;88(Pt B):314-336. doi: 10.1016/j.freeradbiomed.2015.05.036.
[11] Sasako T, Ueki K. [Insulin/IGF-1 signaling and aging]. Nihon Rinsho. 2016 Sep;74(9):1435-1440.
[12] Hadem IKH, Majaw T, Kharbuli B, Sharma R. Beneficial effects of dietary restriction in aging brain. J Chem Neuroanat. 2019 Jan;95:123-133. doi: 10.1016/j.jchemneu.2017.10.001.
[13] Podhorecka M, Ibanez B, Dmoszyńska A. Metformin - its potential anti-cancer and anti-aging effects. Postepy Hig Med Dosw (Online). 2017 Mar 2;71(0):170-175. doi: 10.5604/01.3001.0010.3801.
[14] Phillips T, Leeuwenburgh C. Lifelong aspirin supplementation as a means to extending life span. Rejuvenation Res. 2004 Winter;7(4):243-51. doi: 10.1089/rej.2004.7.243.
[15] de Vries ST, Denig P, Ekhart C, Mol PGM, van Puijenbroek EP. Sex Differences in Adverse Drug Reactions of Metformin: A Longitudinal Survey Study. Drug Saf. 2020 May;43(5):489-495. doi: 10.1007/s40264-020-00913-8.
[16] Johnston SC, Elm JJ, Easton JD, Farrant M, Barsan WG, Kim AS, Lindblad AS, Palesch YY, Zurita KG, Albers GW, Cucchiara BL, Kleindorfer DO, Lutsep HL, Pearson C, Sethi P, Vora N; POINT and Neurological Emergencies Treatment Trials Network Investigators. Time Course for Benefit and Risk of Clopidogrel and Aspirin After Acute Transient Ischemic Attack and Minor Ischemic Stroke. Circulation. 2019 Aug 20;140(8):658-664. doi: 10.1161/CIRCULATIONAHA.119.040713.
[17] Ang L, Lee HW, Kim A, Lee JA, Zhang J, Lee MS. Herbal medicine for treatment of children diagnosed with COVID-19: A review of guidelines. Complement Ther Clin Pract. 2020 May;39:101174. doi: 10.1016/j.ctcp.2020.101174. Epub 2020 Apr 12.
[18] Luo H, Vong CT, Chen H, Gao Y, Lyu P, Qiu L, Zhao M, Liu Q, Cheng Z, Zou J, Yao P, Gao C, Wei J, Ung COL, Wang S, Zhong Z, Wang Y. Naturally occurring anti-cancer compounds: shining from Chinese herbal medicine. Chin Med. 2019 Nov 6;14:48. doi: 10.1186/s13020-019-0270-9.
[19] Yang B, Xie Y, Guo M, Rosner MH, Yang H, Ronco C. Nephrotoxicity and Chinese Herbal Medicine. Clin J Am Soc Nephrol. 2018 Oct 8;13(10):1605-1611. doi: 10.2215/CJN.11571017.
[20] Morvaridzadeh M, Fazelian S, Agah S, Khazdouz M, Rahimlou M, Agh F, Potter E, Heshmati S, Heshmati J. Effect of ginger (Zingiber officinale) on inflammatory markers: A systematic review and meta-analysis of randomized controlled trials. Cytokine. 2020 Nov;135:155224. doi: 10.1016/j.cyto.2020.155224. Epub 2020 Aug 5.
[21] Heshmati J, Moini A, Sepidarkish M, Morvaridzadeh M, Salehi M, Palmowski A, Mojtahedi MF, Shidfar F. Effects of curcumin supplementation on blood glucose, insulin resistance and androgens in patients with polycystic ovary syndrome: A randomized double-blind placebo-controlled clinical trial. Phytomedicine. 2021 Jan;80:153395. doi: 10.1016/j.phymed.2020.153395. Epub 2020 Oct 22.
[22] Wan F, Zhi D, Liu D, Xian J, Li M, AbuLizi A, Ju W, Li H. Lifespan extension in Caenorhabiditis elegans by several traditional Chinese medicine formulas. Biogerontology. 2014 Aug;15(4):377-87. doi: 10.1007/s10522-014-9508-1.
[23] Ning Z, Li Y, Liu D, Owoicho Orgah J, Zhu J, Wang Y, Zhu Y. Tetrahydroxystilbene Glucoside Delayed Senile Symptoms in Old Mice via Regulation of the AMPK/SIRT1/PGC-1α Signaling Cascade. Gerontology. 2018;64(5):457-465. doi: 10.1159/000487360.
[24] Marchese A, Arciola CR, Barbieri R, Silva AS, Nabavi SF, Tsetegho Sokeng AJ, Izadi M, Jafari NJ, Suntar I, Daglia M, Nabavi SM. Update on Monoterpenes as Antimicrobial Agents: A Particular Focus on p-Cymene. Materials (Basel). 2017 Aug 15;10(8):947. doi: 10.3390/ma10080947.
[25] Silva LL, Garlet QI, Benovit SC, Dolci G, Mallmann CA, Bürger ME, Baldisserotto B, Longhi SJ, Heinzmann BM. Sedative and anesthetic activities of the essential oils of Hyptis mutabilis (Rich.) Briq. and their isolated components in silver catfish (Rhamdia quelen). Braz J Med Biol Res. 2013 Sep;46(9):771-9. doi: 10.1590/1414-431X20133013.
[26] Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. BMJ. 2009 Jul 21;339:b2535. doi: 10.1136/bmj.b2535.
[27] Zhang L, Gu B, Wang Y. Clove essential oil confers antioxidant activity and lifespan extension in C. elegans via the DAF-16/FOXO transcription factor. Comp Biochem Physiol C Toxicol Pharmacol. 2021 Apr;242:108938. doi: 10.1016/j.cbpc.2020.108938. Epub 2020 Nov 7.
[28] Chen XY, Liao DC, Yu YT, Wei CM, Xuan LY, Li S, Wang HB. Coix seed oil prolongs lifespan and enhances stress resistance in Caenorhabditis elegans. Biogerontology. 2020 Apr;21(2):245-256. doi: 10.1007/s10522-020-09857-z. Epub 2020 Jan 20.
[29] Yang ZZ, Yu YT, Lin HR, Liao DC, Cui XH, Wang HB. Lonicera japonica extends lifespan and healthspan in Caenorhabditis elegans. Free Radic Biol Med. 2018 Dec;129:310-322. doi: 10.1016/j.freeradbiomed.2018.09.035.
[30] Ruan Q, Qiao Y, Zhao Y, Xu Y, Wang M, Duan J, Wang D. Beneficial effects of Glycyrrhizae radix extract in preventing oxidative damage and extending the lifespan of Caenorhabditis elegans. J Ethnopharmacol. 2016 Jan 11;177:101-10. doi: 10.1016/j.jep.2015.10.008.
[31] Meng F, Li J, Rao Y, Wang W, Fu Y. Gengnianchun Extends the Lifespan of Caenorhabditis elegans via the Insulin/IGF-1 Signalling Pathway. Oxid Med Cell Longev. 2018 Feb 18;2018:4740739. doi: 10.1155/2018/4740739.
[32] Yuan Y, Kang N, Li Q, Zhang Y, Liu Y, Tan P. Study of the Effect of Neutral Polysaccharides from Rehmannia glutinosa on Lifespan of Caenorhabditis elegans. Molecules. 2019 Dec 15;24(24):4592. doi: 10.3390/molecules24244592.
[33] Zhang Z, Zhou Y, Fan H, Billy KJ, Zhao Y, Zhan X, Yang L, Jia Y. Effects of Lycium barbarum Polysaccharides on Health and Aging of C. elegans Depend on daf-12/daf-16. Oxid Med Cell Longev. 2019 Sep 10;2019:6379493. doi: 10.1155/2019/6379493.
[34] Pandey S, Tiwari S, Kumar A, Niranjan A, Chand J, Lehri A, Chauhan PS. Antioxidant and anti-aging potential of Juniper berry (Juniperus communis L.) essential oil in Caenorhabditis elegans model system. Ind Crops Prod. 2018 Sep 15;120:113-22. doi: 10.1016/j.indcrop.2018.04.066.
[35] Pandey T, Sammi SR, Nooreen Z, Mishra A, Ahmad A, Bhatta RS, Pandey R. Anti-ageing and anti-Parkinsonian effects of natural flavonol, tambulin from Zanthoxyllum aramatum promotes longevity in Caenorhabditis elegans. Exp Gerontol. 2019 Jun;120:50-61. doi: 10.1016/j.exger.2019.02.016.
[36] Koch K, Weldle N, Baier S, Büchter C, Wätjen W. Hibiscus sabdariffa L. extract prolongs lifespan and protects against amyloid-β toxicity in Caenorhabditis elegans: involvement of the FoxO and Nrf2 orthologues DAF-16 and SKN-1. Eur J Nutr. 2020 Feb;59(1):137-150. doi: 10.1007/s00394-019-01894-w.
[37] Saier C, Büchter C, Koch K, Wätjen W. Polygonum multiflorum Extract Exerts Antioxidative Effects and Increases Life Span and Stress Resistance in the Model Organism Caenorhabditis elegans via DAF-16 and SIR-2.1. Plants (Basel). 2018 Jul 20;7(3):60. doi: 10.3390/plants7030060.
[38] Cuong VT, Chen W, Shi J, Zhang M, Yang H, Wang N, Yang S, Li J, Yang P, Fei J. The anti-oxidation and anti-aging effects of Ganoderma lucidum in Caenorhabditis elegans. Exp Gerontol. 2019 Mar;117:99-105. doi: 10.1016/j.exger.2018.11.016.
[39] Zhang J, Xue X, Qiao Y, Li D, Wei Q, Zhang F, Qin X. Astragaloside IV Extends Lifespan of Caenorhabditis elegans by Improving Age-Related Functional Declines and Triggering Antioxidant Responses. Rejuvenation Res. 2021 Apr;24(2):120-130. doi: 10.1089/rej.2020.2312. Epub 2020 Sep 1.
[40] Song J, Zhou YZ, Pang YY, Gao L, Du GH, Qin XM. The anti-aging effect of Scutellaria baicalensis Georgi flowers extract by regulating the glutamine-glutamate metabolic pathway in d-galactose induced aging rats. Exp Gerontol. 2020 Feb 8;134:110843. doi: 10.1016/j.exger.2020.110843. Epub ahead of print.
[41] Chen C, Song J, Chen M, Li Z, Tong X, Hu H, Xiang Z, Lu C, Dai F. Rhodiola rosea extends lifespan and improves stress tolerance in silkworm, Bombyx mori. Biogerontology. 2016 Apr;17(2):373-81. doi: 10.1007/s10522-015-9622-8.
[42] Liu Q, Cheng L, Matsuura A, Xiang L, Qi J. Gentiopicroside, a Secoiridoid Glycoside from Gentiana rigescens Franch, Extends the Lifespan of Yeast via Inducing Mitophagy and Antioxidative Stress. Oxid Med Cell Longev. 2020 Aug 2;2020:9125752. doi: 10.1155/2020/9125752.
[43] Zhao M, Tang X, Gong D, Xia P, Wang F, Xu S. Bungeanum Improves Cognitive Dysfunction and Neurological Deficits in D-Galactose-Induced Aging Mice via Activating PI3K/Akt/Nrf2 Signaling Pathway. Front Pharmacol. 2020 Feb 25;11:71. doi: 10.3389/fphar.2020.00071.
[44] Shahroudi MJ, Mehri S, Hosseinzadeh H. Anti-Aging Effect of Nigella Sativa Fixed Oil on D-Galactose-Induced Aging in Mice. J Pharmacopuncture. 2017 Mar;20(1):29-35. doi: 10.3831/KPI.2017.20.006.
[45] Jeong EH, Yang H, Kim JE, Lee KW. Safflower Seed Oil and Its Active Compound Acacetin Inhibit UVB-Induced Skin Photoaging. J Microbiol Biotechnol. 2020 Oct 28;30(10):1567-1573. doi: 10.4014/jmb.2003.03064.
[46] Kang SJ, Choi BR, Kim SH, Yi HY, Park HR, Song CH, Ku SK, Lee YJ. Beneficial effects of dried pomegranate juice concentrated powder on ultraviolet B-induced skin photoaging in hairless mice. Exp Ther Med. 2017 Aug;14(2):1023-1036. doi: 10.3892/etm.2017.4626.
[47] Oh Y, Lim HW, Huang YH, Kwon HS, Jin CD, Kim K, Lim CJ. Attenuating properties of Agastache rugosa leaf extract against ultraviolet-B-induced photoaging via up-regulating glutathione and superoxide dismutase in a human keratinocyte cell line. J Photochem Photobiol B. 2016 Oct;163:170-176. doi: 10.1016/j.jphotobiol.2016.08.026.
[48] Yamada N, Miki K, Yamaguchi Y, Takauji Y, Yamakami Y, Hossain MN, Ayusawa D, Fujii M. Extract of Plumbago zeylanica enhances the growth of hair follicle dermal papilla cells with down-regulation of 5α-reductase type II. J Cosmet Dermatol. 2020 Nov;19(11):3083-3090. doi: 10.1111/jocd.13355.
[49] Zheng Z, Wang M, Cheng C, Liu D, Wu L, Zhu J, Qian X. Ginsenoside Rb1 reduces H2O2‑induced HUVEC dysfunction by stimulating the sirtuin‑1/AMP‑activated protein kinase pathway. Mol Med Rep. 2020 Jul;22(1):247-256. doi: 10.3892/mmr.2020.11096. Epub 2020 Apr 28.
[50] Hooijmans CR, Rovers MM, de Vries RB, Leenaars M, Ritskes-Hoitinga M, Langendam MW. SYRCLE's risk of bias tool for animal studies. BMC Med Res Methodol. 2014 Mar 26;14:43. doi: 10.1186/1471-2288-14-43.
[51] Zeng X, Zhang Y, Kwong JS, Zhang C, Li S, Sun F, Niu Y, Du L. The methodological quality assessment tools for preclinical and clinical studies, systematic review and meta-analysis, and clinical practice guideline: a systematic review. J Evid Based Med. 2015 Feb;8(1):2-10. doi: 10.1111/jebm.12141.
[52] Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med. 2009 Jul 21;6(7):e1000097. doi: 10.1371/journal.pmed.1000097.
[53] Qin Z, Johnsen R, Yu S, Chu JS, Baillie DL, Chen N. Genomic Identification and Functional Characterization of Essential Genes in Caenorhabditis elegans. G3 (Bethesda). 2018 Mar 2;8(3):981-997. doi: 10.1534/g3.117.300338.
[54] Hertweck M, Hoppe T, Baumeister R. C. elegans, a model for aging with high-throughput capacity. Exp Gerontol. 2003 Mar;38(3):345-6. doi: 10.1016/s0531-5565(02)00208-5.
[55] Yu F, Gao J, Zeng Y, Liu CX. Effects of adlay seed oil on blood lipids and antioxidant capacity in hyperlipidemic rats. J Sci Food Agric. 2011 Aug 15;91(10):1843-8. doi: 10.1002/jsfa.4393.
[56] Wang D, Yang C, Wang Z, Yang Y, Li D, Ding X, Xu W, Zheng Q. Norcantharidin combined with Coix seed oil synergistically induces apoptosis and inhibits hepatocellular carcinoma growth by downregulating regulatory T cells accumulation. Sci Rep. 2017 Aug 24;7(1):9373. doi: 10.1038/s41598-017-09668-2.
[57] Lee EB, Xing MM, Kim DK. Lifespan-extending and stress resistance properties of brazilin from Caesalpinia sappan in Caenorhabditis elegans. Arch Pharm Res. 2017 Jul;40(7):825-835. doi: 10.1007/s12272-017-0920-3.
[58] Shang X, Pan H, Li M, Miao X, Ding H. Lonicera japonica Thunb.: ethnopharmacology, phytochemistry and pharmacology of an important traditional Chinese medicine. J Ethnopharmacol. 2011 Oct 31;138(1):1-21. doi: 10.1016/j.jep.2011.08.016.
[59] Asl MN, Hosseinzadeh H. Review of pharmacological effects of Glycyrrhiza sp. and its bioactive compounds. Phytother Res. 2008 Jun;22(6):709-24. doi: 10.1002/ptr.2362.
[60] Jin Z, Chen ZB, Cao H, Shen J. Clinical trial of compound glycyrrhizin injection for the treatment of radiation-induced liver disease. Chinese Journal of Clinical Pharmacology. 2010;26(3):183-5.
[61] Chang Y, Li YL. Observation on the therapeutic effect of licorice Xie Heart soup in treating peptic ulcer. Journal of Emergency Traditional Chinese medicine, 2014;23(6):1145-6.
[62] Mao T, Mao N, Wu T, Han JZ. Clinical observation of compound Glycyrrhizin capsules in treatment 318 patients with skin disease. China Medicine and Pharmacy. 2014;4(9):107-8.
[63] Meng F, Li J, Wang W, Fu Y. Gengnianchun, a Traditional Chinese Medicine, Enhances Oxidative Stress Resistance and Lifespan in Caenorhabditis elegans by Modulating daf-16/FOXO. Evid Based Complement Alternat Med. 2017;2017:8432306. doi: 10.1155/2017/8432306.
[64] Höferl M, Stoilova I, Schmidt E, Wanner J, Jirovetz L, Trifonova D, Krastev L, Krastanov A. Chemical Composition and Antioxidant Properties of Juniper Berry (Juniperus communis L.) Essential Oil. Action of the Essential Oil on the Antioxidant Protection of Saccharomyces cerevisiae Model Organism. Antioxidants (Basel). 2014 Feb 24;3(1):81-98. doi: 10.3390/antiox3010081.
[65] Misharina TA, Terenina MB, Krikunova NI. [Antioxidant properties of essential oils]. Prikl Biokhim Mikrobiol. 2009 Nov-Dec;45(6):710-6.
[66] Johnson AN. Emergency relief planning and management through dynamic agent-based reallocation and tasking (DART). Procedia Engineering. 2015;107:168-71. doi: 10.1016/j.proeng.2015.06.070.
[67] Addor FAS, Cotta Vieira J, Abreu Melo CS. Improvement of dermal parameters in aged skin after oral use of a nutrient supplement. Clin Cosmet Investig Dermatol. 2018 Apr 30;11:195-201. doi: 10.2147/CCID.S150269.
[68] Hasnat MA, Pervin M, Cha KM, Kim SK, Lim BO. Anti-inflammatory activity on mice of extract of Ganoderma lucidum grown on rice via modulation of MAPK and NF-κB pathways. Phytochemistry. 2015 Jun;114:125-36. doi: 10.1016/j.phytochem.2014.10.019.
[69] Huang SQ, Ning ZX. Extraction of polysaccharide from Ganoderma lucidum and its immune enhancement activity. Int J Biol Macromol. 2010 Oct 1;47(3):336-41. doi: 10.1016/j.ijbiomac.2010.03.019.
[70] Xu F, Cui WQ, Wei Y, Cui J, Qiu J, Hu LL, Gong WY, Dong JC, Liu BJ. Astragaloside IV inhibits lung cancer progression and metastasis by modulating macrophage polarization through AMPK signaling. J Exp Clin Cancer Res. 2018 Aug 29;37(1):207. doi: 10.1186/s13046-018-0878-0.
[71] Eijkelenboom A, Burgering BM. FOXOs: signalling integrators for homeostasis maintenance. Nat Rev Mol Cell Biol. 2013 Feb;14(2):83-97. doi: 10.1038/nrm3507.
[72] Roh JS, Han JY, Kim JH, Hwang JK. Inhibitory effects of active compounds isolated from safflower (Carthamus tinctorius L.) seeds for melanogenesis. Biol Pharm Bull. 2004 Dec;27(12):1976-8. doi: 10.1248/bpb.27.1976.
[73] Jung SK, Lee KW, Kim HY, Oh MH, Byun S, Lim SH, Heo YS, Kang NJ, Bode AM, Dong Z, Lee HJ. Myricetin suppresses UVB-induced wrinkle formation and MMP-9 expression by inhibiting Raf. Biochem Pharmacol. 2010 May 15;79(10):1455-61. doi: 10.1016/j.bcp.2010.01.004.
[74] Li HQ, Liu QZ, Liu ZL, Du SS, Deng ZW. Chemical composition and nematicidal activity of essential oil of Agastache rugosa against Meloidogyne incognita. Molecules. 2013 Apr 9;18(4):4170-80. doi: 10.3390/molecules18044170.
[75] Inui S, Itami S. Molecular basis of androgenetic alopecia: From androgen to paracrine mediators through dermal papilla. J Dermatol Sci. 2011 Jan;61(1):1-6. doi: 10.1016/j.jdermsci.2010.10.015.
[76] Quyyumi AA. Endothelial function in health and disease: new insights into the genesis of cardiovascular disease. Am J Med. 1998 Jul 6;105(1A):32S-39S. doi: 10.1016/s0002-9343(98)00209-5.
[77] Minamino T, Miyauchi H, Yoshida T, Ishida Y, Yoshida H, Komuro I. Endothelial cell senescence in human atherosclerosis: role of telomere in endothelial dysfunction. Circulation. 2002 Apr 2;105(13):1541-4. doi: 10.1161/01.cir.0000013836.85741.17.
[78] Ota H, Eto M, Kano MR, Kahyo T, Setou M, Ogawa S, Iijima K, Akishita M, Ouchi Y. Induction of endothelial nitric oxide synthase, SIRT1, and catalase by statins inhibits endothelial senescence through the Akt pathway. Arterioscler Thromb Vasc Biol. 2010 Nov;30(11):2205-11. doi: 10.1161/ATVBAHA.110.210500.
[79] Ruan Y, Wu S, Zhang L, Chen G, Lai W. Retarding the senescence of human vascular endothelial cells induced by hydrogen peroxide: effects of 17beta-estradiol (E2) mediated mitochondria protection. Biogerontology. 2014 Aug;15(4):367-75. doi: 10.1007/s10522-014-9507-2.
[80] Xiong Y, Shen L, Liu KJ, Tso P, Xiong Y, Wang G, Woods SC, Liu M. Antiobesity and antihyperglycemic effects of ginsenoside Rb1 in rats. Diabetes. 2010 Oct;59(10):2505-12. doi: 10.2337/db10-0315.
[81] Chen S, Li X, Wang Y, Mu P, Chen C, Huang P, Liu D. Ginsenoside Rb1 attenuates intestinal ischemia/reperfusion‑induced inflammation and oxidative stress via activation of the PI3K/Akt/Nrf2 signaling pathway. Mol Med Rep. 2019 May;19(5):3633-3641. doi: 10.3892/mmr.2019.10018.
[82] Sun Q, Meng QT, Jiang Y, Liu HM, Lei SQ, Su WT, Duan WN, Wu Y, Xia ZY, Xia ZY. Protective effect of ginsenoside Rb1 against intestinal ischemia-reperfusion induced acute renal injury in mice. PLoS One. 2013 Dec 4;8(12):e80859. doi: 10.1371/journal.pone.0080859.
[83] Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang R. A C. elegans mutant that lives twice as long as wild type. Nature. 1993 Dec 2;366(6454):461-4. doi: 10.1038/366461a0.
[84] Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloën A, Even PC, Cervera P, Le Bouc Y. IGF-1 receptor regulates lifespan and resistance to oxidative stress in mice. Nature. 2003 Jan 9;421(6919):182-7. doi: 10.1038/nature01298.
[85] Nakae J, Biggs WH 3rd, Kitamura T, Cavenee WK, Wright CV, Arden KC, Accili D. Regulation of insulin action and pancreatic beta-cell function by mutated alleles of the gene encoding forkhead transcription factor Foxo1. Nat Genet. 2002 Oct;32(2):245-53. doi: 10.1038/ng890.
[86] Morris JZ, Tissenbaum HA, Ruvkun G. A phosphatidylinositol-3-OH kinase family member regulating longevity and diapause in Caenorhabditis elegans. Nature. 1996 Aug 8;382(6591):536-9. doi: 10.1038/382536a0.
[87] Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. daf-2, an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans. Science. 1997 Aug 15;277(5328):942-6. doi: 10.1126/science.277.5328.942.
[88] Dorman JB, Albinder B, Shroyer T, Kenyon C. The age-1 and daf-2 genes function in a common pathway to control the lifespan of Caenorhabditis elegans. Genetics. 1995 Dec;141(4):1399-406. doi: 10.1093/genetics/141.4.1399.
[89] Paradis S, Ailion M, Toker A, Thomas JH, Ruvkun G. A PDK1 homolog is necessary and sufficient to transduce AGE-1 PI3 kinase signals that regulate diapause in Caenorhabditis elegans. Genes Dev. 1999 Jun 1;13(11):1438-52. doi: 10.1101/gad.13.11.1438.
[90] Gil EB, Malone Link E, Liu LX, Johnson CD, Lees JA. Regulation of the insulin-like developmental pathway of Caenorhabditis elegans by a homolog of the PTEN tumor suppressor gene. Proc Natl Acad Sci U S A. 1999 Mar 16;96(6):2925-30. doi: 10.1073/pnas.96.6.2925.
[91] Ogg S, Ruvkun G. The C. elegans PTEN homolog, DAF-18, acts in the insulin receptor-like metabolic signaling pathway. Mol Cell. 1998 Dec;2(6):887-93. doi: 10.1016/s1097-2765(00)80303-2.
[92] Mihaylova VT, Borland CZ, Manjarrez L, Stern MJ, Sun H. The PTEN tumor suppressor homolog in Caenorhabditis elegans regulates longevity and dauer formation in an insulin receptor-like signaling pathway. Proc Natl Acad Sci U S A. 1999 Jun 22;96(13):7427-32. doi: 10.1073/pnas.96.13.7427.
[93] Lee SS, Kennedy S, Tolonen AC, Ruvkun G. DAF-16 target genes that control C. elegans life-span and metabolism. Science. 2003 Apr 25;300(5619):644-7. doi: 10.1126/science.1083614.
[94] Murphy CT, McCarroll SA, Bargmann CI, Fraser A, Kamath RS, Ahringer J, Li H, Kenyon C. Genes that act downstream of DAF-16 to influence the lifespan of Caenorhabditis elegans. Nature. 2003 Jul 17;424(6946):277-83. doi: 10.1038/nature01789.
[95] North BJ, Verdin E. Sirtuins: Sir2-related NAD-dependent protein deacetylases. Genome Biol. 2004;5(5):224. doi: 10.1186/gb-2004-5-5-224.
[96] Toiber D, Sebastian C, Mostoslavsky R. Characterization of nuclear sirtuins: molecular mechanisms and physiological relevance. Handb Exp Pharmacol. 2011;206:189-224. doi: 10.1007/978-3-642-21631-2_9.
[97] Sasaki T, Maier B, Bartke A, Scrable H. Progressive loss of SIRT1 with cell cycle withdrawal. Aging Cell. 2006 Oct;5(5):413-22. doi: 10.1111/j.1474-9726.2006.00235.x. Epub 2006 Aug 25. Erratum in: Aging Cell. 2006 Dec;5(6):585.
[98] Anwar T, Khosla S, Ramakrishna G. Increased expression of SIRT2 is a novel marker of cellular senescence and is dependent on wild type p53 status. Cell Cycle. 2016 Jul 17;15(14):1883-97. doi: 10.1080/15384101.2016.1189041.
[99] Yamashita S, Ogawa K, Ikei T, Udono M, Fujiki T, Katakura Y. SIRT1 prevents replicative senescence of normal human umbilical cord fibroblast through potentiating the transcription of human telomerase reverse transcriptase gene. Biochem Biophys Res Commun. 2012 Jan 6;417(1):630-4. doi: 10.1016/j.bbrc.2011.12.021.
[100] Jeong J, Juhn K, Lee H, Kim SH, Min BH, Lee KM, Cho MH, Park GH, Lee KH. SIRT1 promotes DNA repair activity and deacetylation of Ku70. Exp Mol Med. 2007 Feb 28;39(1):8-13. doi: 10.1038/emm.2007.2.
[101] Yuan Z, Seto E. A functional link between SIRT1 deacetylase and NBS1 in DNA damage response. Cell Cycle. 2007 Dec 1;6(23):2869-71. doi: 10.4161/cc.6.23.5026.
[102] Oberdoerffer P, Michan S, McVay M, Mostoslavsky R, Vann J, Park SK, Hartlerode A, Stegmuller J, Hafner A, Loerch P, Wright SM, Mills KD, Bonni A, Yankner BA, Scully R, Prolla TA, Alt FW, Sinclair DA. SIRT1 redistribution on chromatin promotes genomic stability but alters gene expression during aging. Cell. 2008 Nov 28;135(5):907-18. doi: 10.1016/j.cell.2008.10.025.
[103] Kawahara TL, Michishita E, Adler AS, Damian M, Berber E, Lin M, McCord RA, Ongaigui KC, Boxer LD, Chang HY, Chua KF. SIRT6 links histone H3 lysine 9 deacetylation to NF-kappaB-dependent gene expression and organismal life span. Cell. 2009 Jan 9;136(1):62-74. doi: 10.1016/j.cell.2008.10.052.
[104] Xu Z, Zhang L, Fei X, Yi X, Li W, Wang Q. The miR-29b-Sirt1 axis regulates self-renewal of mouse embryonic stem cells in response to reactive oxygen species. Cell Signal. 2014 Jul;26(7):1500-5. doi: 10.1016/j.cellsig.2014.03.010.
[105] Kaeberlein M, McVey M, Guarente L. The SIR2/3/4 complex and SIR2 alone promote longevity in Saccharomyces cerevisiae by two different mechanisms. Genes Dev. 1999 Oct 1;13(19):2570-80. doi: 10.1101/gad.13.19.2570.
[106] Rogina B, Helfand SL. Sir2 mediates longevity in the fly through a pathway related to calorie restriction. Proc Natl Acad Sci U S A. 2004 Nov 9;101(45):15998-6003. doi: 10.1073/pnas.0404184101.
[107] Tissenbaum HA, Guarente L. Increased dosage of a sir-2 gene extends lifespan in Caenorhabditis elegans. Nature. 2001 Mar 8;410(6825):227-30. doi: 10.1038/35065638.
[108] Kanfi Y, Naiman S, Amir G, Peshti V, Zinman G, Nahum L, Bar-Joseph Z, Cohen HY. The sirtuin SIRT6 regulates lifespan in male mice. Nature. 2012 Feb 22;483(7388):218-21. doi: 10.1038/nature10815.
[109] Berdichevsky A, Viswanathan M, Horvitz HR, Guarente L. C. elegans SIR-2.1 interacts with 14-3-3 proteins to activate DAF-16 and extend life span. Cell. 2006 Jun 16;125(6):1165-77. doi: 10.1016/j.cell.2006.04.036.
[110] Wang Y, Tissenbaum HA. Overlapping and distinct functions for a Caenorhabditis elegans SIR2 and DAF-16/FOXO. Mech Ageing Dev. 2006 Jan;127(1):48-56. doi: 10.1016/j.mad.2005.09.005.
[111] Curtis R, O'Connor G, DiStefano PS. Aging networks in Caenorhabditis elegans: AMP-activated protein kinase (aak-2) links multiple aging and metabolism pathways. Aging Cell. 2006 Apr;5(2):119-26. doi: 10.1111/j.1474-9726.2006.00205.x.
[112] Sun Y, Hu X, Hu G, Xu C, Jiang H. Curcumin Attenuates Hydrogen Peroxide-Induced Premature Senescence via the Activation of SIRT1 in Human Umbilical Vein Endothelial Cells. Biol Pharm Bull. 2015;38(8):1134-41. doi: 10.1248/bpb.b15-00012.
[113] Song Z, Liu Y, Hao B, Yu S, Zhang H, Liu D, Zhou B, Wu L, Wang M, Xiong Z, Wu C, Zhu J, Qian X. Ginsenoside Rb1 prevents H2O2-induced HUVEC senescence by stimulating sirtuin-1 pathway. PLoS One. 2014 Nov 11;9(11):e112699. doi: 10.1371/journal.pone.0112699.
© KMCRIC 한의약 과학 한마당