- 부작용 분석 데이터모델 구축 -
식품의약품안전처는 신뢰성 있는 의약품 안전정보 확보를 위해 병원 전자의무기록(EHR; Electronic Health Record)을 활용한 부작용 분석 공통데이터모델(K-CDM; Korean Common Data Model)을 구축했습니다.
K-CDM은 다양한 전자의무기록 양식에 기록된 환자 질병 관련 정보 중 ‘인구통계학적 정보, 진단, 처방약, 시술, 검사결과’ 등 부작용 분석에 필수적인 공통 데이터를 추출하여 표준 모델화 한 것으로, 개인정보 유출없이 부작용 분석이 가능합니다. 그동안 의약품과 부작용 발생간 인과관계 분석 등을 위해 건보공단·심평원의 보험청구자료를 활용하여 왔으나 보험청구자료는 비급여로 진행되는 검사·치료 등이 누락되어 있고 약물복용과 검사·처치에 대한 선후관계 등이 명확하지 않아 정확한 분석에 한계가 있었습니다.
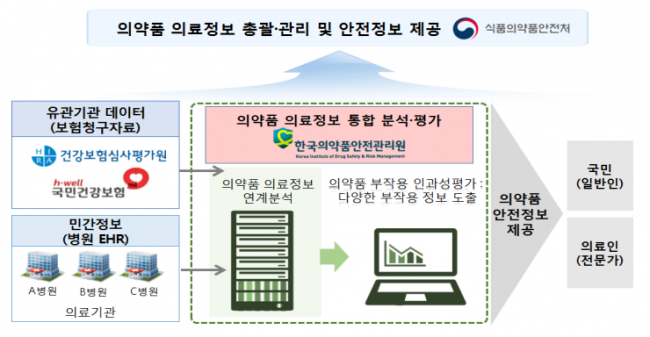
의약품 부작용-의료정보 연계분석 체계
올해는 서울대학교병원 등 병·의원 4곳에서 치료를 받은 적이 있는 308,000여명의 환자 정보를 K-CDM으로 구축했고 향후 5년간 전국 27개 지역의약품안전센터를 중심으로 병원 전자의무기록에 대한 K-CDM 구축을 확대할 계획입니다.
식약처는 이번 K-CDM 구축으로 특정약물이 한국인에서 나타나는 부작용 등을 분석하여 맞춤형 의약품 안전정보를 제공할 수 있을 것으로 보고, 앞으로도 의약품 안전사용 환경을 조성하는데 최선을 다할 것입니다.
출처: 식품의약품안전처 '식약지킴이' 블로그